Helium (2), neon (10), argon (18) is examined in the electron distributions
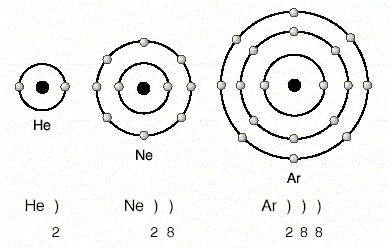
Eğer bu üç elementin birer elektronu daha olsaydı, her birinde yeni bir katman oluşacaktı. If one of these three elements would be more electrons, each one would create a new layer. Çünkü her üçünün de en dıştaki katmanları tamamen dolu durumdadır. Because all three of the outermost layer is completely filled.
1.Katmanda en çok 2 elektron bulunması durumu dublet kuralı , 2. 2 electrons in the case 1.Katmanda most dublet rule, 2 ve 3. and 3 katmanlarda en çok 8 elektron bulunması durumu oktet kuralı olarak adlandırılır. layer in the case of most 8 electrons is known as oktet rule. Helyum dublet, neon ve argon oktet kuralına uyar. Dublet helium, neon and argon warned oktet rule. Oktet veya dublet kuralına uyan atomlar kararlı yapıya sahiptir. Determined the structure of atoms or dublet rule Oktet has awaken.
Diğer elementler de kararlı yapıya sahip olmak isterler. Other elements also want to have stable structures. Bu yüzden elektron alır veya verirler. So give or take electrons.
Son yörüngesindeki elektron sayısı az olan lityum (3), berilyum (5) gibi elementler elektron verme eğilimindedir. Recently the number of electrons in orbits with low lithium (3), beryllium (5) elements, such as electrons tend to.
Oksijen(8), flor(9) elementleri ise elektron almaya yatkındır. Oxygen (8), fluoride (9) elements are likely to receive the electrons.
Atomlar elektron alarak veya vererek kararlı yapıya ulaştıklarında artık, iyon olarak adlandırılırlar. Determined by the electron structure of atoms, or when they reach it, are known as ions.
Nötr bir atomun elektron almış veya vermiş haline iyon denir. Gave a neutral atom into the electron or ion is taken.
Atom elektron alarak kararlı hale geçerse elektron sayısı>proton sayısı olur. Stabilize the electron-atom number of electrons that if> is the number of protons. Bu tür iyonlara negatif (-) yüklü iyon (anyon) denir. This type of negative ions (-) installed ion (anion) is called.
Atom elektron vererek kararlı hale geçerse elektron sayısı (+)yüklü iyon (katyon) denir. If the number of electron-electron atom is determined by the (+) installed ion (cation) is called.
Atomlar kaybettikleri elektron sayısı kadar +yüklü, kazandıkları elektron sayısı kadar – yüklü olurlar. Atoms are lost by the number of electrons + installed, the winner as the number of electrons - are installed. Not: iyon yükü =proton sayısı- elektron sayısı Note: The number of proton-ion load = number of electrons
Eğer iyon anyonsa sembolün sağ üst kısmına – işareti konur ve aldığı elektron sayısı yazılır. If the top right of the symbol is anion ion - and will mark the number of electrons is written. Katyonsa + işareti konur ve sayısı yazılır. Cation and the number is printed on the + sign are placed.
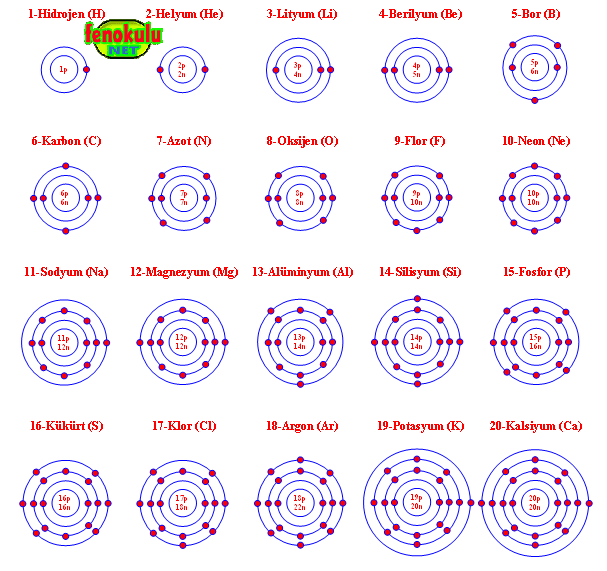
Elementlerin Atom Modelleri : Elements of the Atomic Models:
|